צום לסירוגין, אכילה בשעות האור וארוחת לילה
השפעות על רגישות לאינסולין ואיזון סוכר
צום לסירוגין ותזמון ארוחות הפכו מדפוסי אכילה שנחקרים במעבדה, לכלים נפוצים ומקובלים בטיפול התזונתי. אך הם מעמידים למבחן המלצות ותיקות. אחת הבולטות שבהן היא 'ארוחת הלילה' לחולי סוכרת, שנועדה לאזן את רמות הסוכר בצום אך נראה שעומדת בסתירה לידע המדעי המצטבר. בכתבה זו נבחן את העדויות המעודכנות על השפעת עיתוי האכילה וצום לסירוגין על המטבוליזם, ונשאל: האם לארוחת הלילה קיים בסיס מדעי או שאולי הגיע הזמן לזנוח את המלצה זו.
הציגה את הוובינר חגית גילבר דיאטנית קלינית .M.Sc, מטפלת בכל סוגי הסוכרת ומנהלת בפורום הסוכרת בעמותת עתיד.
צום לסירוגין (Intermittent fasting)
תחת המונח צום לסירוגין, נכללות שלוש גישות עיקריות של אכילה מוגבלת:
- Alternate-day fasting (ADF) – צום יומי לסירוגין.
- Whole-day fasting (WDF) – המוכרת ביותר היא דיאטת 5:2. חמישה ימי אכילה רגילים, ויומיים (בחלק מהמקרים עוקבים) של צום במהלך השבוע.
- Time-restricted eating (TRE) – זוהי הגישה הנפוצה והמוכרת ביותר בשנים האחרונות. גישה זו מתמקדת בהגדרת חלון זמן יומי קבוע לאכילה. כשהשיטה הפופולרית ביותר היא 16:8 (8 שעות אכילה ו-16 שעות של צום).
הערה: בחלק מהמחקרים שעסקו ב-ADF וב-WDF, "צום" אינו בהכרח הימנעות מוחלטת מאוכל, אלא צמצום קלורי משמעותי לכ-500-600 קלוריות ליום.
מנגנונים משוערים להשפעות של צום לסירוגין על מטבוליזם
- מעבר מטבולי לסירוגין – בזמן צום, הגוף עובר משימוש בגלוקוז לשימוש בחומצות שומן ובגופי קטו כמצעים אנרגטיים עיקריים. מהלך זה עשוי להוביל לשינויים תאיים שמתבטאים בין היתר בשיפור רגישות הרקמות לאינסולין. גופי קטו משמשים גם כמולקולות איתות, המשפיעות על תפקוד תאי וביטוי גנים וכך עשויות להפחית תהליכי דלקת ועקה (סטרס) חמצונית.
- שיפור פרופיל אדיפוקינים – הצום מוביל לעלייה בריכוז ההורמון אדיפונקטין וירידה בריכוז ההורמון לפטין. השינויים הללו קשורים בעלייה ברגישות לאינסולין.
- הפחתת סטרס חמצוני – עלייה בביטוי של נוגדי חימצון, הפחתה בייצור חומרים מחמצנים ושיפור במטבוליזם המיטוכונדריאלי.
- שיפור בתגובה החיסונית – שינוי במאזן הציטוקינים: עלייה בביטוי של ציטוקינים אנטי-דלקתיים וירידה באלו הפרו-דלקתיים.
- מסלול ה-mTOR ואוטופגיה – ירידה במסלול ה-mTOR המובילה לדעיכה של מנגנוני הזדקנות, דיכוי יצירת תאים סרטניים והפעלה של מנגנוני אוטופגיה (ניקוי ומיחזור רכיבים תאיים פגומים).
חשוב לציין שעל אף שהמנגנונים הללו נשמעים מבטיחים, הם לרוב מבוססים על מחקרים בתרביות תאים ומחקרים על מכרסמים ורק מיעוטם הוכחו בבני אדם. כפי שנראה בהמשך הכתבה, יישום של צום לסירוגין בבני אדם עשוי להוביל גם לירידה במשקל ושיפור במדדים מטבוליים, ככל הנראה בין היתר עקב ההגבלה קלורית הנוצרת באופן טבעי כתוצאה מהגבלת זמני האכילה.
צום לסירוגין – השפעות קרדיו-מטבוליות באוכלוסייה כללית
שתי מטא-אנליזות של מחקרי RCT הראו כי צום לסירוגין היה קשור בממצאים מבטיחים של שיפור ברמות גלוקוז בצום ובעמידות לאינסולין (HOMA-IR) המטא-אנליזה הראשונה הראתה גם שיפור בהמוגלובין מסוכרר (HbA1C), הפחתה ברמות LDL ושיפור במדדי דלקת (IL-6). המטא-אנליזה השנייה הראתה גם ירידה ב-BMI, ירידה ברמות הלפטין ועלייה ברמות אדיפונקטין.
האם צום לסירוגין עדיף על הגבלה קלורית רגילה? מטא-אנליזה רחבת היקף מ-2025 כללה 99 מחקרים עם מעל 6500 נחקרים השוותה בין אסטרטגיות שונות של צום לסירוגין, וגם להגבלה קלורית ולאכילה ללא הגבלה:
כלומר, נראה כי חלק ניכר מההשפעות המיטיבות של צום לסירוגין נובע מהעובדה שהוא מהווה כלי נוסף להגבלה קלורית, ולא בזכות מנגנונים ייחודיים הנובעים מעצם הצום.
עם זאת יכולות להיות סיבות נוספות לכך שלא מצאו השפעה משמעותית יותר בעקבות צום לסירוגין, כגון משכי מחקר קצרים, וכן העובדה שלא נבדקה השפעה של חלונות זמן ספציפיים לאכילה (עליהם נרחיב בהמשך). בנוסף הייתה הטרוגניות בקרב הנחקרים שנכללו במטא אנליזה: רק 720 מתוך כלל המשתתפים במחקרים היו בריאים, והשאר כללו מצבים בריאותיים שונים.
צום לסירוגין – השפעות מטבוליות באוכלוסיות עם תסמונת מטבולית וסוכרת מסוג 2
בשנים האחרונות נעשו שלוש מטא אנליזות באוכלוסיות אלו שהדגימו ירידה במשקל וב-BMI עם תוצאות מעורבות בנוגע לשיפור רמות הסוכר והרגישות לאינסולין:
נקודות למחשבה על הממצאים:
בשתי המטא-אנליזות שהתמקדו באנשים עם טרום סוכרת וסוכרת,לא נבדקה השפעה על עמידות לאינסולין, אלא רק על מדדי איזון הסוכרת המסורתיים: סוכר בצום והמוגלובין מסוכרר. עובדה זו משמעותית, שכן ייתכן שלו נבדקה העמידות לאינסולין, ניתן היה לזהות שיפור מטבולי שלא בא לידי ביטוי במדדי האיזון הקשיחים, שקשה יותר להראות בהם שינוי משמעותי במחקרי התערבות קצרי טווח.
הקושי להשפיע על מדדים אלו נובע הן מכך שלסוכר, ובמיוחד להמוגלובין מסוכרר, נדרש זמן רב יחסית לשיפור (כך שייתכן שמשך המחקרים היה קצר מדי). בנוסף בקרב נבדקים אלו קיימת לעיתים פגיעה לא רק ברגישות לאינסולין אלא גם בייצור ובהפרשה שלו, מה שעלול לעכב את השיפור הגליקמי המדיד גם כאשר חלה הטבה ברגישות הרקמות לאינסולין בעקבות הצום.
היבטי בטיחות צום לסירוגין עבור חולי סוכרת
על פי נייר העמדה של ה-ADA מ-2025, דפוס אכילה מוגבל בזמן או קיצור חלון האכילה נחשבים לאסטרטגיות בטוחות ובנות התאמה למבוגרים עם סוכרת מסוג 1 או מסוג 2.
עם זאת, עבור אנשים עם סוכרת הנוטלים אינסולין ו/או טיפול פומי המעודד הפרשת אינסולין, חיוני להיות במעקב רפואי במהלך תקופת הצום. המעקב נדרש על מנת למנוע אירועי היפוגליקמיה הנובעים מהפסקת אכילה מוקדמת או ממושכת, תוך בחינת המינון האינסולין הבזאלי והתאמתו במהלך שעות הצום.
לסיכום השפעות קרדיו-מטבוליות של צום לסירוגין
לצום לסירוגין תיתכן השפעה חיוביות על משקל, BMI ומדדים גליקמיים וקרדיו-מטבוליים, אך נראה כי חלק מההשפעה נובע מההגבלה קלורית ולאו דווקא מהצום עצמו.
תזמון ארוחות (Chrono-nutrition)
בעוד שצום לסירוגין מתמקד במשך הזמן (ביממה או במהלך השבוע) שבו אנו אוכלים או נמנעים מאכילה, התחום של תזמון הארוחות שם דגש על עיתוי צריכת המזון. המוקד של התחום הוא הסנכרון (או חוסר הסנכרון) בין שעות האכילה, מחזורי האור והחושך, וויסות מקצבים צירקדיים ותוצאים קרדיו-מטבולים.
הבסיס הביולוגי לגישה זו, נשען על השעון הציקרדי ב-SCN (אזור בהיפותלמוס שנקרא Suprachiasmatic Nucleus) שעון המוודא שהתהליכים הפיזיולוגיים בגוף יהיו מסונכרנים עם שעות היום והלילה ומדגים את היותנו יצורים (שאמורים להיות) פעילים ביום. ויסות המקצבים הצירקדיים חיוני לוויסות רמות סוכר, משקל ובריאות כללית, בעוד ששיבוש או חוסר סנכרון של המקצבים קשור לסיכון גבוה יותר לסוכרת סוג 2, פגיעה באיזון הסוכר והשמנה.

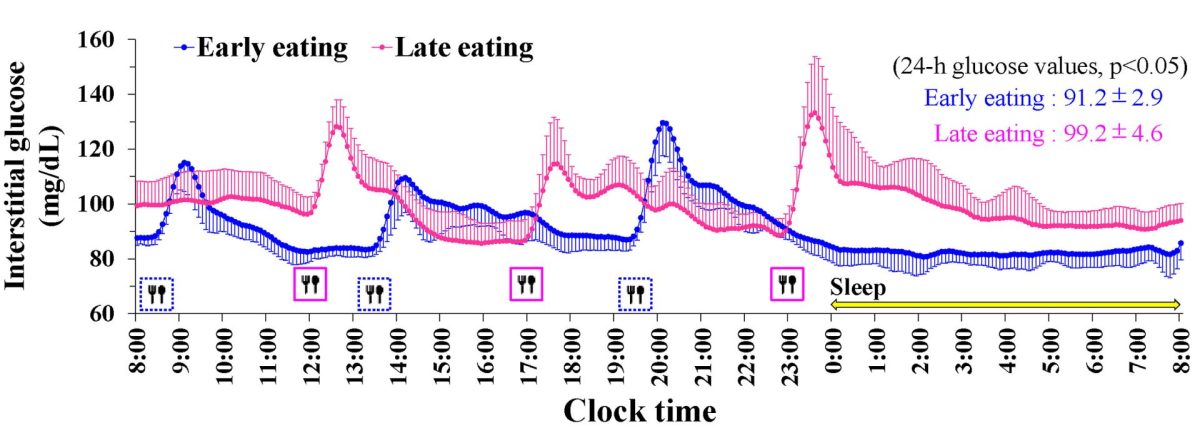
מחקרים תצפיתיים מחזקים את הקשר בין שיבוש השעון הביולוגי לבריאות מטבולית. כך למשל' עבודה במשמרות קשורה עם סיכון מוגבר לסוכרת סוג 2 ואכילה בשעות מאוחרות קשורה עם איזון גליקמי ירוד בקרב חולי סוכרת סוג 2.
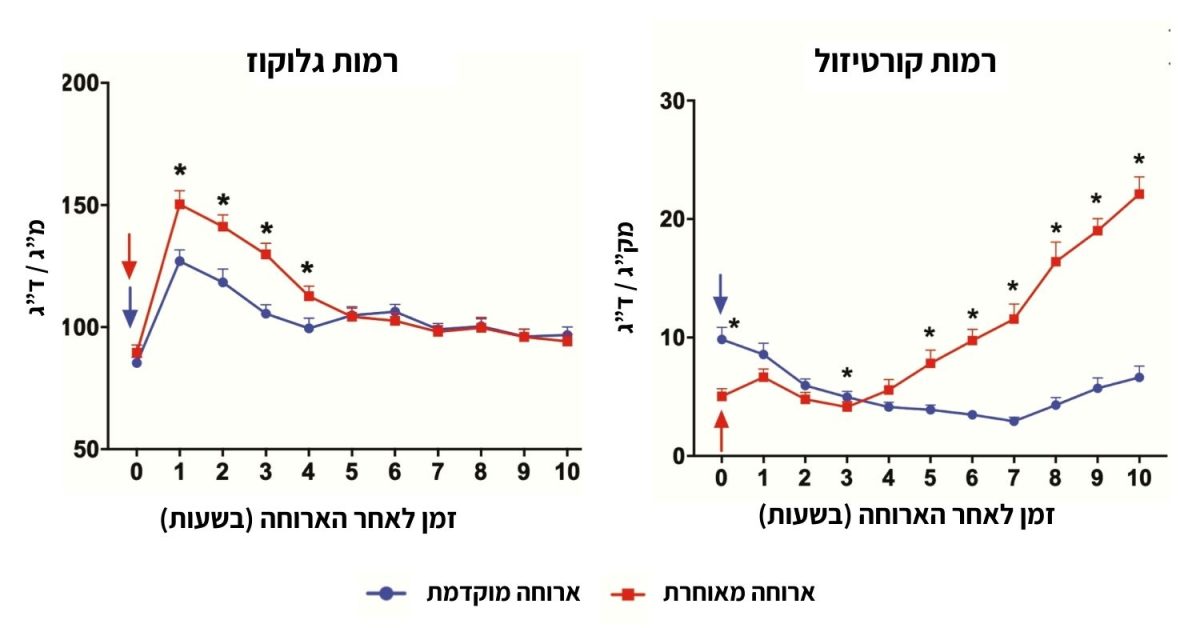
כדי להבין את המנגנונים הפיזיולוגיים העומדים בבסיס תצפיות אלו, מחקרים קליניים בוחנים את ההשפעה של ארוחה מאוחרת בשתי גישות עיקריות:
ארוחת לילה למניעת תופעת השחר ואיזון רמות גלוקוז בצום: האם ההמלצה מבוססת ראיות?
"תופעת השחר", המתבטאת בהיפרגליקמיה בשעות הבוקר המוקדמות מופיעה בקרב כמחצית מחולי הסוכרת. בבסיס התופעה עומדת עמידות לאינסולין בכבד, המפריעה לוויסות תהליכי ייצור אנדוגני של גלוקוז (גלוקונאוגנזה וגליקוגנוליזה) המתרחשים בכבד לפנות בוקר.
לשעון הצירקדי המרכזי בהיפותלמוס (ב-SCN) יש תפקיד מפתח בתופעה הזו, כיוון שהוא מווסת את הריתמוס היומי של ייצור הגלוקוז ואת מידת הרגישות לאינסולין של הכבד, באמצעות מכניזם נוירו-הורמונלי. שיבושים בשעון הצירקדי בקרב חולי סוכרת מסוג 2 עלולים להאריך את תופעת השחר ולהוביל להיפרגליקמיה לאחר ארוחת הבוקר.
בהמשך לשורת המחקרים שהדגימה כי ארוחה מאוחרת עלולה דווקא להוביל לירידה ברגישות לאינסולין, נראה כי אין הצדקה מדעית להמלצה על ארוחת לילה לתיקון רמות הסוכר בצום בבוקר. מאחר שהגורם המרכזי בבסיס התופעה הוא עמידות לאינסולין, היעד הטיפולי הנכון הוא שיפור הרגישות לאינסולין. ארוחה מאוחרת כמו ארוחת לילה, פועלת במגמה הפוכה ועלולה להחמיר את הבעיה במקום לתקן אותה. למעשה ההמלצה המוכרת לאנשים עם סוכרת לאכילה של ארוחת לילה אינה קיימת (ומעולם לא היתה קיימת) בדפי העמדה הרשמיים של ארגוני הסוכרת בעולם.
להמחשה מעשית של ניהול תופעת השחר ללא ארוחת לילה, כדאי לצפות בתיאורי המקרה שהוצגו בחלקו האחרון של הוובינר.
אף שנדרשים מחקרים נוספים, בשנים האחרונות מצטברות עדויות משמעותיות ליתרונות קרדיו-מטבוליים בצריכת מזון מוקדמת יותר ביום. נראה כי אכילה בשעות מאוחרות עלולה להוביל לעלייה בעמידות לאינסולין ובאי סבילות לגלוקוז ככל הנראה על רקע שיבוש של שעונים צירקדיים. בהתאם לכך, נראה כי אין הצדקה מדעית להמלצה המסורתית על ארוחת לילה לתיקון רמות הסוכר בצום בבוקר. נהפוך הוא, ארוחה מאוחרת עלולה להחמיר את העמידות לאינסולין העומדת בבסיס תופעת השחר.
ברמה המעשית, במציאות חברתית המעודדת אכילה מאוחרת, האתגר הקליני הוא לסייע למטופלים להקדים את שעת סיום האכילה ככל האפשר, במיוחד אצל מטופלים הנוטים לאכול ארוחות בשעות הלילה. המפתח ליישום מוצלח אינו מסתכם רק בכוח רצון, אלא בבניית שובע נכונה לאורך שעות היום. מעבר לתזמון הארוחה, גם לצמצום נפח הארוחה, והקפדה על הרכבה עשויה להיות השפעה מיטיבה על האיזון המטבולי.
לסיום, לאכילה מוקדמת ולצום לילה יש פוטנציאל להשפעות קרדיו-מטבוליות מיטיבות, שאינן תלויות רק בירידה במשקל. עם זאת, חשוב לזכור שצום לבדו הוא לא פתרון קסם, ולא בהכרח ישיג שיפור במדדים גליקמיים ומטבוליים ו/או ירידה במשקל, יש לראות בו כלי משלים ומשמעותי בתוך מעטפת רחבה יותר של תזונה בריאה ואורח חיים בריא – הכולל התייחסות טיפולית ליישום של פעילות גופנית, הרגלי השינה והתייחסות מעמיקה הן להרכב הארוחות והן לתזמון האכילה.
תכנים נוספים שעשויים לעניין אותך