كيف تعمل التغذية؟
الآليات الجزيئية للتغذية والأمراض
التغذية هي واحدة من أهم عوامل الخطر لجميع أنواع الأمراض. كيف تؤثر الطعام على صحتنا؟ في هذه المقالة، نرغب في إلقاء الضوء على بعض الآليات الأساسية التي من خلالها يؤثر الطعام على تبادل المواد في أجسامنا.
نحن مصدرنا من الطعام
قد يبدو هذا تقليديًا، ولكنه صحيح: الطعام هو الحياة. الطعام ومكوناته هي الأساس لهيكل أجسامنا ولتبادل موادها. بدون طعام، لا توجد تطور، لا نمو، لا حرارة، لا حركة، لا تكاثر، ولا إدراك
بالمقارنة مع عوامل الخطر الأخرى مثل التدخين، قلة النشاط البدني أو الإشعاع فوق البنفسجي، فإن التغذية هي عامل أكثر تعقيدًا. نحن بحاجة إلى أنواع متعددة من الطعام، وكل عنصر غذائي مصنوع من آلاف المواد التي تؤثر على أجسامنا. بالإضافة إلى ذلك، هذه المواد ليست تعمل عادة بشكل منفصل، بل في مزج يكون لكل منها تأثيرات محددة خاصة به.
يمكن تقسيم مكونات الطعام إلى مجموعتين: المغذيات الكبيرة والمغذيات الصغيرة.
المغذيات الكبيرة ووظائفها
تشترك المغذيات الكبيرة مثل البروتينات والكربوهيدرات والدهون في شيء مشترك: إنها توفر طاقة للكائن الحي. يقوم المغذيات الصغيرة مثل الفيتامينات والمعادن بدور داعم أكبر في تبادل المواد، أي أنها تعمل كعوامل مساعدة أو إنزيمات.
الكربوهيدرات هي مصدر الطاقة الرئيسي لأجسامنا. إنها ضرورية لتخليق الحمض النووي والريبوزي، وبالتآزر مع البروتينات والدهون، تنتج الجليكوبروتينات والجليكوليبيدات التي تساعد على اتصال الخلايا ونقل الإشارات.
البروتينات توفر أيضًا طاقة للجسم وتعمل كمواد بناء للجسم. كإنزيمات، تعمل أيضًا كـ “أدوات” جزيئية في تبادل المواد لدينا، وبالتالي فهي ضرورية لكل استجابة كيميائية. البروتينات البعض منها مقاوم للجسيمات، عناصر حيوية في الجهاز المناعي. البروتينات الهيكلية تبني هيكل الأنسجة وكل مورفولوجية أجسامنا. الميوزين والأكتين، اثنان من البروتينات المهمة، ضروريين لبناء العضلات وبالتالي لقدرة جسمك على التحرك. البروتينات ضرورية أيضًا لنقل جزيئات مثل الأوكسجين والحديد، وتشارك في عملية تخثير الدم اللازمة لوقف النزيف.
الدهون، أو الأحماض الدهنية، هي مخازن طاقة لأجسامنا. وبالإضافة إلى ذلك، فهي ضرورية لامتصاص الفيتامينات الذائبة في الدهون مثل فيتامين E، D، K، A. إنها جزء من تركيب الخلية وغلاف الميالين، وتوفر حماية لأعضاء الجسم. هناك العديد من أنواع الأحماض الدهنية تنقسم إلى ثلاث مجموعات رئيسية: الأحماض الدهنية المشبّعة، الأحماض الدهنية غير المشبعة مرة واحدة، مثل أوميغا 9، والأحماض الدهنية غير المشبعة متعددة الأوميغا 6 وأوميغا 3. حمض الدهن أوميغا 3 ضروري لوظيفة غلاف الخلية ولتخليق البروتاجلاندينات المضادة للالتهابات.
الميكرونوترينتات ودورهم في عملية تبادل المواد
الميكرونوترينتات، مثل الفيتامينات، المعادن أو المواد الكيميائية النباتية، هي مواد تأتي من الطعام، لكنها لا توفر طاقة للجسم. إنها تقوم بدور في ردود الفعل التفاعلات بنئ وتحليل في عملية تبادل المواد. هناك آلاف الميكرونوترينتات، لذلك في هذه المقالة يمكننا ذكر بعضها فقط وبذلك نستعرض بعض وظائفها العديدة.
اليود، على سبيل المثال، هو عنصر كيميائي ضروري لتخليق الهرمونات التي تفرزها غدة الدرقية، مثل الثيروكسين والثريودوتيرونين.
الحديد هو عنصر غذائي أساسي حيوي مطلوب في عملية التمثيل الغذائي. إنه المكون الرئيسي لصبغة الهيموغلوبين والميوغلوبين، وبالتالي يتطلب لنقل الأكسجين. كما يشكل جزءاً هاماً من العديد من الإنزيمات، ويشارك في سلسلة نقل الإلكترونات في الميتوكوندريا أثناء إنتاج ATP.
فيتامين K يقوم بدور مركزي في تنشيط عملية تخثر الدم، وهو مشارك في أيض العظم.
ما يحدث للجسم عندما يكون هناك فائض أو نقص؟
كما يمكن ملاحظته، للماواد الغذائية الكبيرة والصغيرة أدوار متعددة للغاية، ولذلك يمكن أن يؤدي النقص أو الزيادة فيها إلى عرقلة تبادل
المواد.
على سبيل المثال: الجوع، أي نقص في الماكرونترينتية والمايكرونترينتية، يؤدي إلى الهزال (cachexia) وفي النهاية الموت. في الأطفال، يمكن أن يؤدي التغذية غير المتوازنة إلى تأخير النمو.
في مقدار أقل بعضًا، يؤدي النقص الغذائي إلى التعب وفقر الدم والاكتئاب وضعف الشهية وضعف تحسين الجروح وزيادة خطر الاصابة بالالتهابات وانخفاض انتاج القلب.
الحالات الشائعة المرتبطة بنقص الميكرونترينتات هي، على سبيل المثال، فقر الدم (الذي يسبب من بين أمور أخرى نقصًا في الحديد وفيتامين B12، حمض الفوليك)، هشاشة العظام (الكالسيوم، فيتامين D، وغيرها)، نقص اليود، اضطرابات عصبية غروف التائبة (فيتامين B12، حمض الفوليك)، النيووبلازيا الجديدة لسلسلة الحديد (حمض الفوليك)، تقلصات العضلات (المغنسيوم)، واختلالات في الجهاز المناعي (فيتامينات A، D، E؛ الزنك، الحديد، السيلينيوم). كما أن نقص الفيتوكيماويات مثل البوليفينولات قد يؤثر سلبًا على الصحة، وسيتم مناقشته في وقت لاحق.
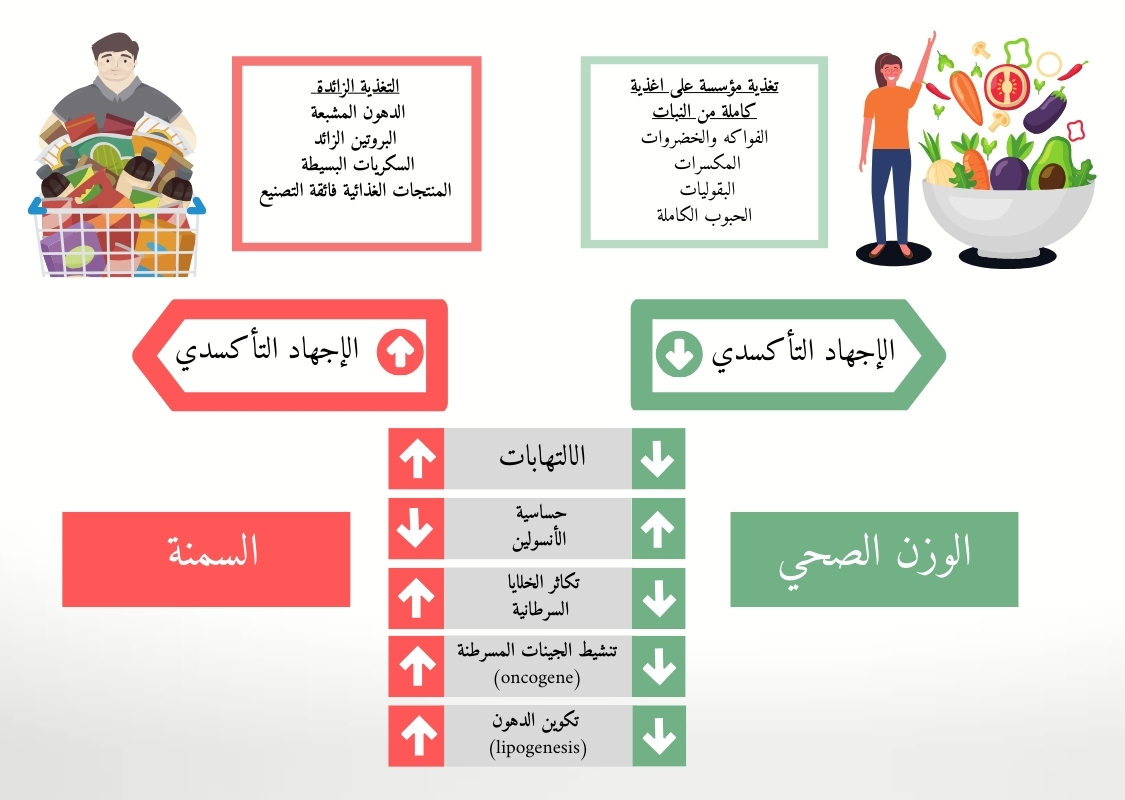
على النقيض من ذلك، يؤدي الفائض في عناصر التغذية إلى السمنة، مما يزيد من خطر الاصابة بأمراض القلب والأوعية الدموية، والسرطان ومشاكل صحية أخرى. استهلاك زائد لمادة معينة مثل الأحماض الدهنية المتحولة، الزئبق، الكادميوم أو الفينوليكيدات الألكيلويدية يؤدي إلى اضطرابات في عمليات الأيض ومشاكل صحية.
ستتم مناقشة التأثيرات العميقة للتغذية أو أنواع التغذية المختلفة في الأجزاء القادمة. على سبيل المثال، تغييرات في إشارات واتصالات الخلايا من خلال الهرمونات، الالتهابات والإجهاد الأكسدة. بالإضافة إلى ذلك، ميكانيزمان آخران مهمان، فائدة الدم والميكروبيوم البشري التي تؤثران بشكل أساسي على الجهاز المناعي، تم شرحهما في مقالتين أخريين على الموقع.
في محاضرة من الدكتورة تسبيا شافير، تم التطرق إلى موضوع المخاطر المرتبطة بفائض استهلاك بعض المغذيات المعينة – تلك التي تظهر كعلامات حمراء على منتجات غذائية مختلفة (الصوديوم، السكر، الدهون المشبعة).
كيف تسبب الإفراط في تناول الطعام اضطرابات أيضية وهرمونية؟
يؤدي الإفراط في تناول الطعام إلى السمنة. تاريخيًا، يُشير هذا المصطلح إلى وجود كمية كبيرة من الأنسجة الدهنية البيضاء. عند الشخص الذي يعاني من السمنة، تفرز الخلايا الدهنية كمية كبيرة من الأحماض الدهنية نتيجة لتحلل الدهون الزائد الناجم عن زيادة نشاط الجهاز العصبي الودي. تسبب هذه الأحماض الدهنية الحرة ضغطًا تأكسديًا في الأنسجة المختلفة، مما يؤدي إلى خلل في مستقبلات الأنسولين، ومقاومة الأنسولين، وارتفاع السكر في الدم. كما أن الأحماض الدهنية الحرة تقلل من استخدام الجلوكوز في العضلات، مما يزيد من ارتفاع السكر في الدم. يجب أن يكون الأنسولين هرمونًا مؤثرًا على تصلب الشرايين، يعزز تطور أمراض القلب والأوعية الدموية.
كيف تسبب التغذية السرطان؟
تفرز الأنسجة الدهنية أيضًا الأديبوكينات، التي تشجع السرطان عن طريق تحفيز عامل النمو الشبيه بالأنسولين 1 (1-IGF) وهرمونات النمو الأخرى، مما يزيد من تكاثر وتمايز الخلايا نتيجة لسلاسل إشارات انقسامية ومضادة للاستماتة. يزيد 1-IGF أيضًا من تكوين الأوعية الدموية الجديدة مما يعزز السرطان. يُعرف هرمون الليبتين، أحد الأديبوكينات الأكثر بحثًا، بخصائصه الانقسامية، والمضادة للاستماتة، والمسببة للالتهابات، وكلها متورطة في تطور الأورام السرطانية. لا تشجع الأنسجة الدهنية البيضاء وحدها على السرطان، ولكن أيضًا مكونات الطعام المسرطنة مثل السموم الفطرية (الميكوتوكسينات). الأفلاتوكسين من الطعام الملوث بالعفن يتداخل مع الحمض النووي، مما يشجع على تطور سرطان الكبد. توجد مركب Benzo[a]pyrene بشكل رئيسي في اللحم المشوي. تعوق أيضات هذا المركب الحمض النووي وتسبب طفرات وسرطان. قد يلعب عدم التوازن بين المؤكسدات والمضادات للأكسدة في الطعام دورًا في تطور السرطان أيضًا، وسنوسع في ذلك في الفقرة التالية.
كيف يسبب الطعام الالتهاب؟
المؤكسدات والمضادات للأكسدة متورطة أيضًا في العملية الالتهابية، وهي آلية مرضية أخرى تتأثر بالتغذية. الالتهاب هو استجابة الخلية للإصابة، ويتسم بزيادة تدفق الدم، ودخول الكريات البيضاء، وإنتاج محلي للوسطاء الالتهابيين بهدف إصلاح الأنسجة المتضررة. هذه الآلية هي الأساس لأمراض مثل الاضطرابات الأيضية، الكبد الدهني غير الكحولي، السكري، وأمراض القلب والأوعية الدموية.
مرة أخرى، الإفراط في التغذية، الذي يسبب من بين أمور أخرى السمنة، هو أحد أهم العوامل للحالات الالتهابية في الجسم. تفرز الأنسجة الدهنية البيضاء، أو بالأحرى تجمعات الدهون حول الأعضاء الداخلية، الأديبوكينات التي تحفز إنتاج السيتوكينات مثل TNF-alpha، IL-1، وIL-6، التي يمكن أن تسبب التهابات واسعة النطاق. هذه آلية أخرى من خلالها تسبب الأنسجة الدهنية خللًا في خلايا بيتا في البنكرياس، وارتفاع السكر في الدم، وفي النهاية السكري. بالمقابل، فإن التوازن السلبي للطاقة، مثل تقييد السعرات الحرارية، يقلل من الالتهاب.
تساهم الالتهابات أيضًا في تطور تصلب الشرايين عن طريق التأثير على وظيفة البطانة وإحداث ضرر في الأوعية الدموية. بالإضافة إلى الأديبوكينات وتأثير الخلايا الدهنية على نظام الرينين-أنجيوتنسين-ألدوستيرون، يعد الضغط التأكسدي عاملًا آخر مشجعًا للالتهاب.
الضغط التأكسدي هو حالة أيضية تتميز بعدم التوازن بين أنواع الأكسجين التفاعلية (ROS) والجزيئات المضادة للأكسدة التي تحيد الجذور الحرة. يمكن أن تؤدي الجذور الحرة إلى تلف جميع مكونات الخلية، بما في ذلك البروتينات، والدهون، والحمض النووي، لذا فإن الإفراط في أنواع الأكسجين التفاعلية التي تسبب الضغط التأكسدي متورط في معظم الأمراض، بدءًا من السرطان وأمراض القلب والأوعية الدموية، وصولًا إلى الاضطرابات العصبية والنفسية. يُعد أكسدة الحمض النووي بواسطة ROS أحد الأسباب الرئيسية للطفرات التي تشجع على السرطان.
الجزيئات المؤكسدة هي منتجات ثانوية لإنتاج الطاقة في عملية التنفس الخلوي، ولكن لها أيضًا مصادر خارجية مثل التدخين، المعادن الثقيلة، والمبيدات. يمكن أن تؤثر التغذية على إنتاج الجزيئات المؤكسدة والمضادة للأكسدة. على سبيل المثال، يزيد استهلاك الأحماض الدهنية المشبعة من الضغط التأكسدي، بينما تعمل الأحماض الدهنية غير المشبعة بشكل أكبر كمضادات للأكسدة.
تعمل البوليفينولات الموجودة في الفواكه، والخضروات، والشوكولاتة الداكنة، والشاي، والقهوة، والنبيذ كمضادات للأكسدة أو تزيد من تعبير الجينات المضادة للأكسدة، وبالتالي تقلل الالتهابات.
في الختام، يشكل الطعام أجسامنا، وتغذي مكوناته أيضنا. يؤثر الطعام على الحمض النووي، وجميع أنظمة الجسم، وصحتنا. تتناول هذه المقالة فقط رؤوس الأقلام للآليات المرضية الأساسية والتفاعلات التي تؤثر عليها التغذية. سنستعرضها بشكل أعمق في المقالات القادمة حول التغذية والأمراض.
لقراءة باقي المقالات في السلسل:
تمت ترجمة المقال بواسطة أديم رابي من سلسلة مقالات “قوة التغذية” (The Power of Nutrition) على موقع المنظمة الدولية PAN International. للمقال الأصلي.
المصادر
- Berg JM, Stryer L, Tymoczko JL, Gatto GJ. Biochemistry. 8th ed. New York: WH Freeman; 2015.
- Palermo A, Tuccinardi D, D’Onofrio L, et al. Vitamin K and osteoporosis: Myth or reality? Metab Clin Exp. 2017;70:57-71. doi:1016/j.metabol.2017.01.032
- Endo J, Arita M. Cardioprotective mechanism of omega-3 polyunsaturated fatty acids. J Cardiol. 2016;67(1):22-27. doi:1016/j.jjcc.2015.08.002
- Joshi MS, Ferguson TB, Johnson FK, Johnson RA, Parthasarathy S, Lancaster JR. Receptor-mediated activation of nitric oxide synthesis by arginine in endothelial cells. Proc Natl Acad Sci USA. 2007;104(24):9982-9987. doi:1073/pnas.0506824104
- Calder PC. Feeding the immune system. Proc Nutr Soc. 2013;72(3):299-309. doi:10.1017/S0029665113001286
- Brouwer IA, Wanders AJ, Katan MB. Trans fatty acids and cardiovascular health: research completed? Eur J Clin Nutr. 2013;67(5):541-547. doi:10.1038/ejcn.2013.43
- Kuo C-C, Howard BV, Umans JG, et al. Arsenic Exposure, Arsenic Metabolism, and Incident Diabetes in the Strong Heart Study. Diabetes Care. 2015;38(4):620-627. doi:10.2337/dc14-1641
- Huang Y, He C, Shen C, et al. Toxicity of cadmium and its health risks from leafy vegetable consumption. Food Funct. 2017;8(4):1373-1401. doi:10.1039/c6fo01580h
- Habs M, Binder K, Krauss S, et al. A Balanced Risk-Benefit Analysis to Determine Human Risks Associated with Pyrrolizidine Alkaloids (PA)-The Case of Tea and Herbal Infusions. Nutrients. 2017;9(7). doi:10.3390/nu9070717
- Spiegelman BM, Flier JS. Obesity and the regulation of energy balance. Cell. 2001;104(4):531-543.
- Redinger RN. The Pathophysiology of Obesity and Its Clinical Manifestations. Gastroenterol Hepatol (N Y). 2007;3(11):856-863.
- Pan DA, Lillioja S, Kriketos AD, et al. Skeletal muscle triglyceride levels are inversely related to insulin action. Diabetes. 1997;46(6):983-988.
- Després JP, Lamarche B, Mauriège P, et al. Hyperinsulinemia as an independent risk factor for ischemic heart disease. N Engl J Med. 1996;334(15):952-957. doi:10.1056/NEJM199604113341504
- Madonna R, Pandolfi A, Massaro M, Consoli A, De Caterina R. Insulin enhances vascular cell adhesion molecule-1 expression in human cultured endothelial cells through a pro-atherogenic pathway mediated by p38 mitogen-activated protein-kinase. Diabetologia. 2004;47(3):532-536. doi:10.1007/s00125-004-1330-x
- Orrù S, Nigro E, Mandola A, et al. A Functional Interplay between IGF-1 and Adiponectin. Int J Mol Sci. 2017;18(10). doi:10.3390/ijms18102145
- Anisimov VN, Bartke A. The key role of growth hormone-insulin-IGF-1 signaling in aging and cancer. Crit Rev Oncol Hematol. 2013;87(3):201-223. doi:10.1016/j.critrevonc.2013.01.005
- Renehan AG, Frystyk J, Flyvbjerg A. Obesity and cancer risk: the role of the insulin-IGF axis. Trends Endocrinol Metab. 2006;17(8):328-336. doi:10.1016/j.tem.2006.08.006
- Lee CH, Woo YC, Wang Y, Yeung CY, Xu A, Lam KSL. Obesity, adipokines and cancer: an update. Clin Endocrinol (Oxf). 2015;83(2):147-156. doi:10.1111/cen.12667
- Kew MC. Aflatoxins as a cause of hepatocellular carcinoma. J Gastrointestin Liver Dis. 2013;22(3):305-310.
- Lee BM, Shim GA. Dietary exposure estimation of benzo[a]pyrene and cancer risk assessment. J Toxicol Environ Health Part A. 2007;70(15-16):1391-1394. doi:10.1080/15287390701434182
- Volk DE, Thiviyanathan V, Rice JS, et al. Solution structure of a cis-opened (10R)-N6-deoxyadenosine adduct of (9S,10R)-9,10-epoxy-7,8,9,10-tetrahydrobenzo[a]pyrene in a DNA duplex. Biochemistry. 2003;42(6):1410-1420. doi:10.1021/bi026745u
- Sharma A, Kaur M, Katnoria JK, Nagpal AK. Polyphenols in Food: Cancer Prevention and Apoptosis Induction. Curr Med Chem. 2018;25(36):4740-4757. doi:10.2174/0929867324666171006144208
- Calder PC, Ahluwalia N, Albers R, et al. A consideration of biomarkers to be used for evaluation of inflammation in human nutritional studies. Br J Nutr. 2013;109 Suppl 1:S1-34. doi:10.1017/S0007114512005119
- Hotamisligil GS. Inflammation and metabolic disorders. Nature. 2006;444(7121):860-867. doi:10.1038/nature05485
- Lafontan M. Fat cells: afferent and efferent messages define new approaches to treat obesity. Annu Rev Pharmacol Toxicol. 2005;45:119-146. doi:10.1146/annurev.pharmtox.45.120403.095843
- Calabro P, Yeh ET. Obesity, inflammation, and vascular disease: the role of the adipose tissue as an endocrine organ. Subcell Biochem. 2007;42:63-91.
- Kershaw EE, Flier JS. Adipose tissue as an endocrine organ. J Clin Endocrinol Metab. 2004;89(6):2548-2556. doi:10.1210/jc.2004-0395
- Fontana L, Meyer TE, Klein S, Holloszy JO. Long-term calorie restriction is highly effective in reducing the risk for atherosclerosis in humans. Proc Natl Acad Sci USA. 2004;101(17):6659-6663. doi:10.1073/pnas.0308291101
- Engeli S, Schling P, Gorzelniak K, et al. The adipose-tissue renin-angiotensin-aldosterone system: role in the metabolic syndrome? Int J Biochem Cell Biol. 2003;35(6):807-825.
- Halliwell B. Oxidative stress and cancer: have we moved forward? Biochemical Journal. 2007;401(1):1-11. doi:10.1042/BJ20061131
- Carini F, Mazzola M, Rappa F, et al. Colorectal Carcinogenesis: Role of Oxidative Stress and Antioxidants. Anticancer Res. 2017;37(9):4759-4766. doi:10.21873/anticanres.11882
- Siti HN, Kamisah Y, Kamsiah J. The role of oxidative stress, antioxidants and vascular inflammation in cardiovascular disease (a review). Vascul Pharmacol. 2015;71:40-56. doi:10.1016/j.vph.2015.03.005
- Niedzielska E, Smaga I, Gawlik M, et al. Oxidative Stress in Neurodegenerative Diseases. Mol Neurobiol. 2016;53(6):4094-4125. doi:10.1007/s12035-015-9337-5
- Jiménez-Fernández S, Gurpegui M, Díaz-Atienza F, Pérez-Costillas L, Gerstenberg M, Correll CU. Oxidative stress and antioxidant parameters in patients with major depressive disorder compared to healthy controls before and after antidepressant treatment: results from a meta-analysis. J Clin Psychiatry. 2015;76(12):1658-1667. doi:10.4088/JCP.14r09179
- Kawanishi S, Ohnishi S, Ma N, Hiraku Y, Murata M. Crosstalk between DNA Damage and Inflammation in the Multiple Steps of Carcinogenesis. Int J Mol Sci. 2017;18(8). doi:10.3390/ijms18081808
- Phaniendra A, Jestadi DB, Periyasamy L. Free Radicals: Properties, Sources, Targets, and Their Implication in Various Diseases. Indian J Clin Biochem. 2015;30(1):11-26. doi:10.1007/s12291-014-0446-0
- Vetrani C, Costabile G, Di Marino L, Rivellese AA. Nutrition and oxidative stress: a systematic review of human studies. International Journal of Food Sciences and Nutrition. 2013;64(3):312-326. doi:10.3109/09637486.2012.738651
- Scalbert A, Manach C, Morand C, Rémésy C, Jiménez L. Dietary polyphenols and the prevention of diseases. Crit Rev Food Sci Nutr. 2005;45(4):287-306. doi:10.1080/1040869059096
- Landberg R, Sun Q, Rimm EB, et al. Selected dietary flavonoids are associated with markers of inflammation and endothelial dysfunction in U.S. women. J Nutr. 2011;141(4):618-625. doi:10.3945/jn.110.133843
- Chun OK, Chung S-J, Claycombe KJ, Song WO. Serum C-reactive protein concentrations are inversely associated with dietary flavonoid intake in U.S. adults. J Nutr. 2008;138(4):753-760. doi:10.1093/jn/138.4.753







